Transformación digital en la calidad del packaging farmacéutico
09 - 09 - 2020
El uso de la tecnología para gestionar el Cumpliminento Regulatorio
1. Introducción
La globalización de toda la industria farmacéutica ha llevado a la aparición diferentes requisitos en distintos países, lo que aumenta la necesidad de disponer de unos estándares de cumplimiento, así como de la necesidad de disponer de un packaging de alta calidad. Ahora más que nunca, las empresas farmacéuticas y de ciencias biológicas deben cumplir con una amplia gama de requisitos y estándares regulatorios creados por organismos gubernamentales como la FDA y la EMA. Estos estándares describen pautas y obligaciones específicas que estas empresas deben cumplir si desean operar a escala global. A medida que aumenta la demanda de medicamentos médicos seguros en todo el mundo, también aumenta la responsabilidad del personal de asuntos regulatorios, que debe garantizar que las pautas recibidas de los órganos rectores se interpreten, apliquen y comuniquen con éxito dentro de la empresa. Esto es esencial para garantizar que sus productos cumplan con los estándares requeridos para la venta en diversas partes del mundo. La localización, o el proceso de adaptar un producto para cumplir con los requisitos legales y culturales de un mercado específico, se ha convertido en una parte integral del papel de los asuntos regulatorios y se ha expandido mucho más allá de las traducciones. Esta guía completa analizará y discutirá cómo la creciente adopción de soluciones tecnológicas es la clave para administrar la localización, el cumplimiento normativo y la calidad del packaging, al tiempo que garantiza que las empresas farmacéuticas tengan las herramientas que necesitan para operar a escala global.
2. Los distintos componentes de localización
Todos los aspectos de la producción farmacéutica, incluidos los asuntos normativos, el envasado y el cumplimiento poscomercialización, deben adherirse a los más altos estándares de control de calidad establecidos por agencias como la FDA y la EMA. A medida que la globalización continúa expandiendo el tamaño del mercado, las empresas farmacéuticas deben coordinar la localización de cada producto que lanzan. Deben asegurarse de que sus productos se comuniquen y estén disponibles en varios idiomas al tiempo que se adhieren a las directivas y los requisitos de cumplimiento de cada región en la que operan. Además de las traducciones, la localización incluye ajustar las preferencias de color, las unidades de medida, los formatos de fecha, las ilustraciones y otros elementos para reflejar cada uno de los mercados.
En la industria farmacéutica, se produce más información en cada una de las etapas del ciclo de vida del producto que en cualquier otro sector del mercado. La documentación legal, folletos, estuches, prospectos y todo el resto del contenido deben desarrollarse para adaptarse a las necesidades únicas de un área geográfica en particular, lo que plantea desafíos para los equipos reguladores cuando se trata de garantizar la precisión del contenido en cada etapa del flujo de trabajo. Además, la velocidad a la que deben lanzarse nuevos medicamentos dificulta que no se produzcan errores a la hora de adaptar los contenidos a los distintos mercados. Esto añade una gran complejidad a un proceso en el que el margen de error ya es pequeño, ya que la falta de una localización correcta puede generar posibles problemas legales y una disminución de los ingresos de los mercados extranjeros.
3. El uso de la tecnología para operar a escala global
Los errores en el packaging se han convertido en una de las principales causas de retiradas y devoluciones en el mercado farmacéutico mundial, ya que el packaging de los productos continúa adaptándose para cumplir con los requisitos de localización. Desde errores ortográficos que aparecen al traducir idiomas extranjeros hasta defectos en las ilustraciones, el riesgo de dejar pasar un error en el packaging es alto. A medida que aumenta el tamaño del mercado y las empresas farmacéuticas se vuelven más dinámicas, las cargas de trabajo regulatorias se vuelven aún más complejas y difíciles de administrar. Los trabajadores cualificados a menudo tienen una gran demanda y escasez de recursos, lo que genera margen de error en áreas como el cumplimiento normativo, la gestión de los diseños y el etiquetado. Para ayudar a lidiar con esta tendencia creciente, cada vez más empresas están introduciendo soluciones digitales en distintas fases de flujo de trabajo.
4. El empleo de la tecnología para operar a escala global
Uno de los mayores desafíos que enfrentan los profesionales de asuntos regulatorios y de control de calidad es la cantidad de datos que deben administrar a diario. Los asuntos regulatorios juegan un papel fundamental al actuar como enlace entre las agencias de salud y varios departamentos dentro de la empresa para garantizar que todos los datos acumulados se transcriben correctamente para crear y comercializar el medicamento. Desde obtener la aprobación de un nuevo producto hasta garantizar que se apliquen las pautas correctas de la FDA al etiquetado en términos de contenido y formato, el departamento de cumplimiento regulatorio participa en muchos aspectos diferentes de la producción. Además, se deben realizar revisiones en cada etapa del flujo de trabajo de creación de archivos para garantizar que la información sea precisa y cumpla con lo aprobado. Una forma clave de gestionar eficazmente las crecientes cargas de trabajo como resultado de la globalización es aprovechar las soluciones tecnológicas que permitan que los asuntos regulatorios de la industria farmacéutica operen a escala global. En lo que respecta a la corrección de pruebas, los procesos manuales ya no son factibles dado el tamaño y la velocidad con la que deben entregarse los productos. Se hace necesario utilizar sistemas de control de calidad digitales para verificar la precisión del contenido en archivos digitales y materiales de embalaje impresos, eliminando la necesidad de revisión manual y las ineficiencias que conlleva.

5. Digitalización de los procesos de control de calidad
La revisión de pruebas automatizada se puede implementar en cada etapa del flujo de trabajo para garantizar que no se hayan introducido errores. Para comenzar, los requisitos de productos y medicamentos se envían a los organismos reguladores, quienes luego compilan la información en documentos informativos para que los revise la agencia reguladora correspondiente. La implementación de un sistema de control de calidad digital en esta etapa garantiza que todos los documentos de copia estén libres de errores y sean precisos para las revisiones internas y las presentaciones reglamentarias al inspeccionar automáticamente los documentos con mucho texto, carácter por carácter. En la etapa de creación de la ilustración, los archivos de la ilustración se pueden inspeccionar automáticamente para asegurarse de que no se introdujeron errores durante el proceso de creación. A menudo se incluyen defectos de cumplimiento como errores de logotipo, información incorrecta y defectos en los códigos de barras. Las inspecciones digitales pueden continuar a medida que se editan los archivos para garantizar que no se hayan agregado otros errores. Es imperativo que el contenido sea preciso en cada etapa del proceso, en todos los departamentos. Una solución de revisión digital también ayuda a realizar un seguimiento de los cambios de versión entre departamentos, lo que reduce los ciclos de aprobación prolongados y el tiempo de comercialización. En la etapa final, el software de control de calidad digital puede comparar automáticamente los archivos aprobados con las pruebas del proveedor antes de imprimirse, lo que garantiza que los productos lleguen al mercado con un packaging totalmente libre de errores. Los sistemas digitales mejoran aún más la eficiencia general del flujo de trabajo del envasado farmacéutico, ya que reducen los ciclos de revisión y detectan errores al principio del proceso, sin importar cuán pequeños sean.
Otro desafío para los profesionales reguladores de la industria es la gestión de contenidos en idiomas extranjeros. A medida que los medicamentos continúan llegando a los mercados extranjeros, los envases, los prospectos con mucho texto y las instrucciones de uso deben traducirse a varios idiomas. Las traducciones a menudo se subcontratan a empresas externas que pueden traducir más de 2000 palabras por día, lo que deja un margen de error considerable. Las soluciones tecnológicas pueden ayudar a gestionar esto de forma eficaz mejorando la gestión de documentos, el control de versiones y la garantía de calidad a través de la revisión automatizada que admite múltiples idiomas. En la industria farmacéutica, las pautas de cumplimiento e integridad de los datos son esenciales. Los datos brutos deben conservarse en caso de investigaciones. Las herramientas de control de calidad digital utilizan registros de auditoría para rastrear todas las acciones, asegurando el cumplimiento de organismos como las certificaciones ISO, 21 CFR Parte 11 y el Anexo 11. Las pruebas de auditoría son importantes ya que son la clave para mantener la integridad de los datos mediante el seguimiento de todas las actividades, incluidas las inspecciones e informes. Los informes de inspección completos ayudan a proteger la integridad de los datos al proporcionar una trazabilidad completa sobre quién inspeccionó un producto y cuáles fueron los resultados de la inspección. Estos informes realizan un seguimiento y revisan todas las diferencias encontradas entre archivos, lo que garantiza que se realicen los cambios correctos.
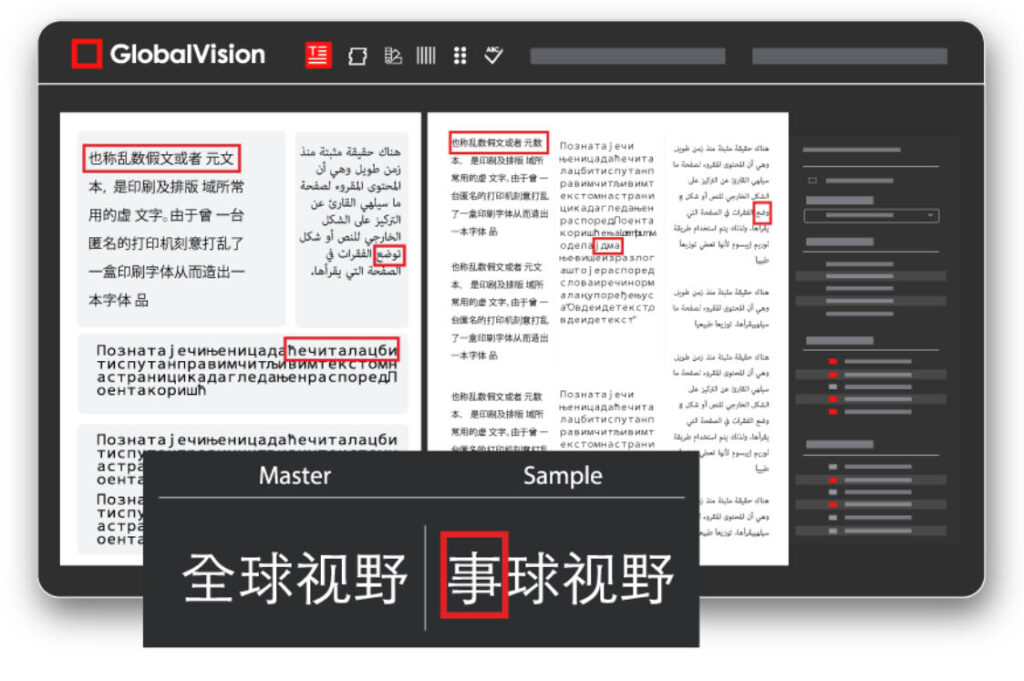
No hay duda de que las soluciones digitales actúan como un seguro contra errores potencialmente catastróficos, como la falta de puntos decimales en las cifras de dosificación, el valor que brindan a las compañías farmacéuticas se extiende mucho más allá de eliminar la corrección manual. A medida que la naturaleza de los estándares regulatorios continúa evolucionando, también lo hace la necesidad de implementar de manera efectiva soluciones tecnológicas como el control de calidad automatizado. Estas innovaciones tecnológicas no solo mejoran los procesos entre equipos, sino que también aumentan la colaboración interfuncional y brindan a las empresas farmacéuticas las herramientas que necesitan para poder operar a escala global.